Électrolyse de la solution aqueuse de sulfate de cuivre
Expérience
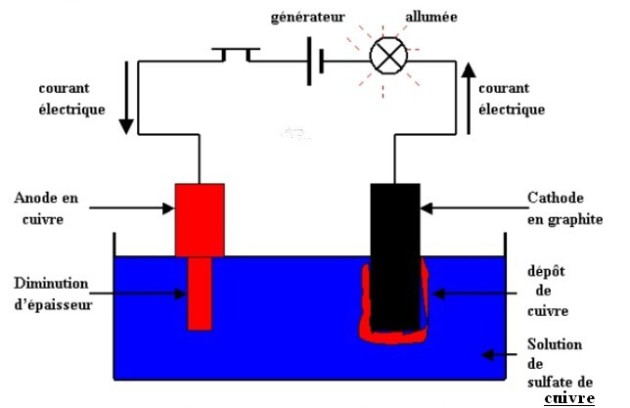
On réalise l'expérience schématisée ci-dessous :
Dans le montage ci-dessus, les deux conducteurs (tige de cuivre et graphite) plongés dans la solution sont appelés électrodes.
L'électrode reliée à la borne positive du générateur est appelée anode et celle reliée à la borne négative du générateur est appelée cathode.
Observations
Quelques minutes après la fermeture du circuit, on constate que :
la lampe s'allume ;
la solution bleue conserve sa couleur ;
il y a des modifications au niveau des électrodes : l'anode diminue d'épaisseur alors que la cathode augmente d'épaisseur.
Interprétations
La lampe s'allume : la solution de sulfate de cuivre conduit le courant électrique. C'est donc un électrolyte.
Les modifications aux électrodes prouvent qu'il s'est produit des réactions chimiques aux électrodes.
A l'anode : des atomes de cuivre disparaissent pendant que des ions cuivre apparaissent dans la solution selon l'équation : Cu ⟶ Cu2+ + 2e-
A la cathode : des atomes de cuivre apparaissent pendant que des ions cuivre disparaissent de la solution selon l'équation : Cu2+ + 2e- ⟶ Cu
Conclusion
Un électrolyte est une solution aqueuse conductrice du courant électrique.
L'électrolyse est l'ensemble des réactions chimiques qui se produisent quand un courant électrique traverse un électrolyte.
Le passage de l'atome de cuivre en ion cuivre (et inversement) s'est fait à l'aide du courant électrique : il s'agit d'une transformation électrochimique.
Définition :
Une transformation électrochimique est une transformation chimique qui se fait à l'aide du courant électrique.