Équation d'une réaction d'oxydoréduction spontanée
Fondamental :
Le réducteur le plus fort cède des électrons, c'est une oxydation Rédfort ⇄ Oxfaible+ x e-
L'oxydant le plus fort capte des électrons, c'est une réduction Oxfort + y e- ⇆ Rédfaible
On équilibre ensuite pour avoir l'équation-bilan : y Rédfort + x Oxfort⟶ x Rédfaible + y Oxfaible
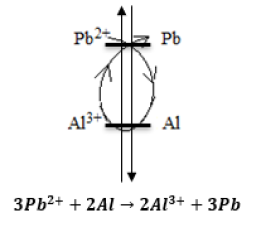
Fondamental : La règle de gamma
On peut inscrire la lettre entre les couples redox extraits du tableau de classification, on parle alors de la règle du gamma.
Exemple : Réaction entre l'aluminium et les ions plomb