Classification électrochimique quantitative de quelques couples redox
Exemple : 1
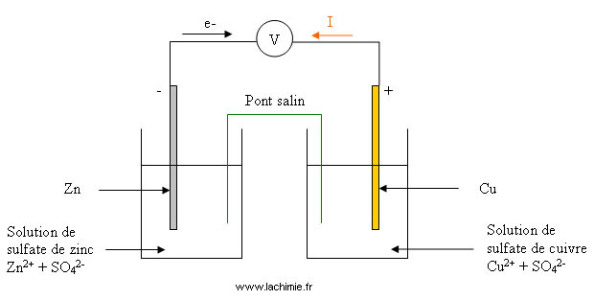
Soit la pile : Zn | Zn2+ ¦¦ Cu2+ | Cu
Le voltmètre indique 1,08 V d'où E = 1,08 V. On déduit donc que VCu- VZn = 1,08V. Cela signifie que dans la classification, le couple Cu2+/Cu est situé à 1,08 au-dessus du couple Zn2+/ Zn
Exemple : 2
Soit la pile : Cu | Cu2+ ¦¦ Ag+ | Ag
Le voltmètre indique 0,46 V d'où E = 0,46 V. On déduit donc que VAg - VCu = 0,46 V. Cela signifie que dans la classification, le couple Ag+/Ag est situé à 0,46 au-dessus du couple Ag+/Ag
Exemple : 3
Soit la pile : Zn | Zn2+ ¦¦ Ag+ | Ag
Le voltmètre indique 1,54 V d'où E = 1,54 V. On déduit donc que VAg - VZn = 1,54 V. Cela signifie que dans la classification, le couple Ag+/ Ag est situé à 1,54 au-dessus du couple Zn2+/ Zn
Fondamental :
L' étude comparative des diverses piles permet d'obtenir une classification électrochimique des couples redox. Pour ces trois piles étudiées, on a la classification suivante :
Syntaxe : Conclusion
La mesure de la force électromotrice de différentes piles permet de classer quantitativement des couples redox.