La classification périodique des éléments
Repérage d'un élément dans le tableau
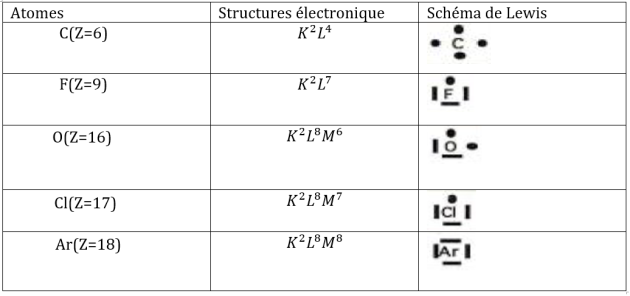
La position d'un élément dans le tableau de classification est déterminée grâce à sa structure électronique.
Les éléments dont les atomes ont le même nombre d'électrons sur la dernière couche sont disposés dans une même colonne (famille) ; Il y a 18 familles.
Le nombre d'électrons sur la dernière couche correspond à la colonne (Il faut ajouter 10, lorsque le nombre d'électrons sur la dernière couche est supérieur à 2.
Chaque ligne du tableau périodique est appelée période et son numéro correspond au nombre de couches.
Exemple : Exemple
Pour Na (Z=11) ; K2 L8 M1; il appartient à la troisième (3e) période et à la première (1ère) famille.
Pour C(Z=6) ; K2 L4 ; il appartient à la deuxième (2e) période et à la quatorzième (14é) famille.
Intérêt de la classification
La famille des alcalins
Excepté l'hydrogène, tous les éléments de la première colonne sont appelés des alcalins. Ils ont tous un seul électron sur la couche externe.
Exemple : Lithium, sodium, potassium
La famille des halogènes
Elle regroupe les éléments de la 17e colonne. Il manque à chaque élément de cette colonne, un seul électron pour la que la couche externe soit saturée (remplie).
Exemple : fluor, chlore, brome, iode,...
La famille des gaz rares ou gaz nobles
Ce sont les éléments de la 18e colonne. Ils ont tous leurs derrières couches saturées.
Ce sont des gaz inertes chimiquement.