Action sur les métaux : réaction avec le zinc (Zn)
Simulation :
Si l'on introduit de l'acide chlorhydrique et de la grenaille de zinc dans un tube à essais, on remarque un dégagement de dihydrogène H2 et la disparition progressive de la grenaille de zinc.
On note aussi la présence d'ions zinc Zn2+ que l'on peut mettre en évidence avec la soude.
L'équation bilan de la réaction s'écrit alors :

Le métal zinc se transforme en ions zinc par perte de 2 électrons : Le zinc a donc été oxydé.

Les ions hydroniums captent chacun 2 électrons pour donner de l'eau et du dihydrogène : Les ions hydroniums ont été réduits.

Remarque :
Si l'on évapore la solution obtenue après la réaction, les ions zinc Zn2+ s'associent aux ions chlorure Cl- pour former le chlorure de zinc solide (ZnCl2) .
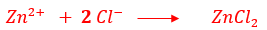
Attention :
Tous les métaux ne réagissent pas avec l'acide chlorhydrique, c'est le cas du cuivre (Cu), de l'argent (Ag), de l'or (Au) et du mercure (Hg).