Étude d'une solution aqueuse d'hydroxyde de sodium
Solution d'hydroxyde de sodium
L'hydroxyde de sodium ou soude caustique est un solide ionique blanc, le plus souvent sous forme de paillettes ou de pastilles.
Sa formule statistique est NaOH. Il est très soluble dans l'eau et sa dissolution est très exothermique.
Une solution aqueuse d'hydroxyde de sodium contient des ions sodium Na+ et des ions hydroxyde OH-.
Caractère ionique total de la solution d'hydroxyde de sodium
Une solution aqueuse d'hydroxyde de sodium de concentration initiale Cb = 10-2mol/L a un pH = 12 à 25°C.
Faire le bilan des espèces chimiques présentes dans la solution
Calculer leurs concentrations. Conclure.
Méthode : Résolution générale
Les espèces chimiques présentes dans la solution : H2O; OH- ; Na+; H3O+ (apporté par l'autoprotolyse de l'eau).
Calcul des concentrations :
A partir du pH : [H3O+] = 10-pH = 10-12mol/L
A partir du produit ionique de l'eau : Ke = [H3O+] . [OH-] → [OH-] = Ke / [H3O+]
[OH-] = 10-14/10-12 → [OH-] = 10-2mol/L
Les ions H3O+ sont ultra minoritaires par rapport aux ions OH- .
De l'électroneutralité de la solution : [Na+] + [H3O+] = [OH-] → [Na+]
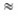 [OH-] car [H3O+]
[OH-] car [H3O+] 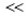 [OH-] ; alors [Na+] = 10-2mol/L
[OH-] ; alors [Na+] = 10-2mol/L
Conclusion : On constate que : [Na+]= [OH-] = Cb.
L'ionisation de NaOH est totale. L'hydroxyde de sodium est une base forte.
Fondamental :
Une solution d'hydroxyde de sodium contient majoritairement des ions Na+et OH- et ultra minoritairement des ions H3O+.