Constante d'acidité du couple acide éthanoïque /ion éthanoate (CH3-COOH / CH3-COO-) dans l'eau
Il existe un équilibre chimique lors de la réaction de l'acide éthanoïque avec l'eau.
Pour chaque équilibre chimique, on peut définir une constante d'équilibre pour l'acide éthanoïque en solution aqueuse.

La constante est notée Ka.
Ka est appelée constante d'acidité du couple CH3-COOH/CH3-COO- dans l'eau.
La valeur caractéristique du couple CH3-COOH/CH3-COO- dans l'eau ne dépend que de la température.
A 25°C, Ka (CH3COOH/CH3-COO- )= 1,6.10-5.
Remarque :
La constante d'acidité, comme le produit ionique de l'eau s'exprime sans unité.
Notion de pKa,relation pH et pKa du couple
On définie le pKa comme étant -logKa
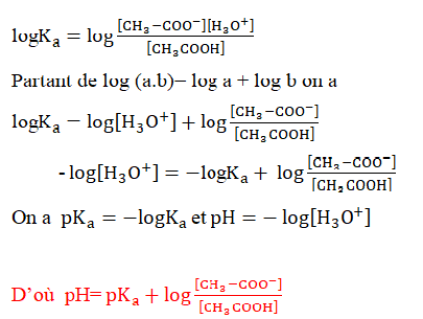
Pour le couple CH3-COOH/CH3-COO- on a : pKa=-log(1,6.10-5)
pKa=4,8
Remarque :
pKa=-logKa donc on a : Ka=10-pKa