Coefficient d'ionisation α
Fondamental :
Le coefficient d'ionisation α d'un acide est le rapport de la quantité de molécules d'acide dissociées à la quantité de molécules d'acide mises en solution.
Pour un acide faible qui réagit avec l'eau selon l'équation :
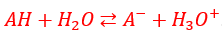
Le coefficient d'ionisation se calcule en utilisant la relation :
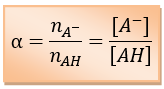
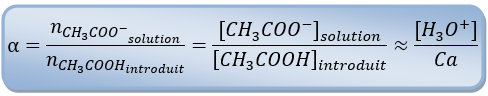
Dans le cas de l'acide éthanoïque on a ∶
Exemple :
Pour l'acide éthanoïque on aura : d'où
Sur 100 molécules d'acide éthanoïque introduites dans la solution, seulement quatre (4) molécules se dissocient. La dissociation ou l'ionisation de l'acide éthanoïque dans l'eau est donc partielle (limitée). L'acide éthanoïque est un acide faible.
Remarque :
Le coefficient d'ionisation augmente avec la dilution.