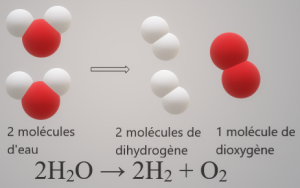
L'équation-bilan de l'électrolyse de l'eau
La molécule d'eau
La molécule d'eau est formée à partir de deux atomes d'hydrogène liés à un même atome d'oxygène. La figure ci-contre montre un modèle de la molécule d'eau. L'élément oxygène est représenté en rouge et l'élément hydrogène en blanc. La formule chimique de la molécule d'eau est donc H2O. |  |
Méthode : Équation-bilan de l'électrolyse de l'eau
Au cours de l'électrolyse de l'eau, de l'eau disparaît tandis qu'il se forme du dihydrogène et du dioxygène. L'électrolyse de l'eau est donc une réaction chimique dont l'équation-bilan est : 2H2O → 2H2 + O2
Les coefficients placés devant les formules traduisent la conservation des éléments chimiques lors d'une réaction chimique c'est-à-dire qu'au cours d'une réaction chimique, tous les éléments présents dans les réactifs sont présents dans les produits. Il n'y a ni apparition de nouveaux éléments, ni disparition des éléments en présence, ni transformation des éléments chimiques en d'autres éléments. Quand les coefficients sont placés de sorte à traduire la conservation des éléments, on dit alors que l'équation chimique est équilibrée.
On remarque effectivement que quatre atomes d'hydrogène et deux atomes d'oxygène qui forment deux molécules d'eau se retrouvent dans deux molécules de dihydrogène et une molécule de dioxygène.
Fondamental :
Une équation-bilan doit toujours être équilibrée.