Variation du pH au cours de la réaction de dosage
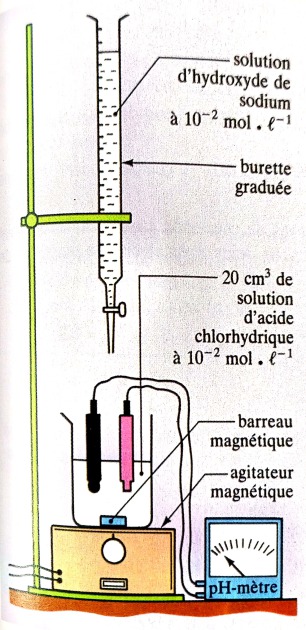
Mode opératoire
Introduisons dans le bécher un volume VA = 20 cm3 d'une solution d'acide chlorhydrique de concentration molaire CA= 10-2 mol.L-1. Versons goutte par goutte à l'aide d'une burette graduée , une solution d’hydroxyde de sodium de concentration molaire CB = 10-2 mol.L-1.
Relevons d'abord le pH de la solution initiale de l’acide chlorhydrique ensuite la valeur du pH du mélange après chaque ajout à l'aide d’un pH-mètre.
Le schéma du dispositif expérimental est :
Remarque :
Un agitateur magnétique assure une bonne homogénéisation de la solution obtenue dans le bécher.
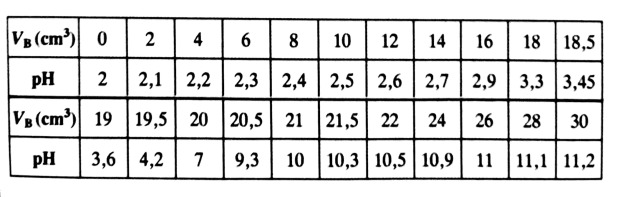
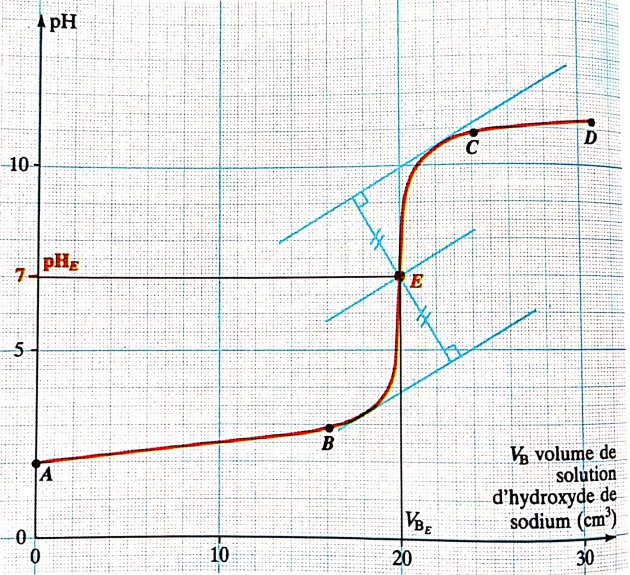
Tracé de la courbe de pH en fonction du volume d'hydroxyde de sodium ajouté : pH= f(VB)
Principales caractéristiques de la courbe pH en fonction du volume d'hydroxyde de sodium versé : pH= f(VB)
Cette courbe est croissante et présente trois parties distinctes :
Pour 0 cm3 ≤ VB ≤ 16 cm3 (partie AB) : la courbe est presque rectiligne et le pH varie peu lors de l'ajout de la solution d'hydroxyde de sodium ;
Pour 16 cm3< VB ≤ 22 cm3 (partie BC ) :la courbe est verticale et change de concavité.Cette partie est appelée "saut du pH" ;
Pour VB > 22 cm3 ( partie CD) la courbe est légèrement croissante et tend vers une asymptote horizontale.
Remarque :
Dans la deuxième partie ,il existe un point d'inflexion dont les coordonnées seront déterminées par la méthode des tangentes parallèles.
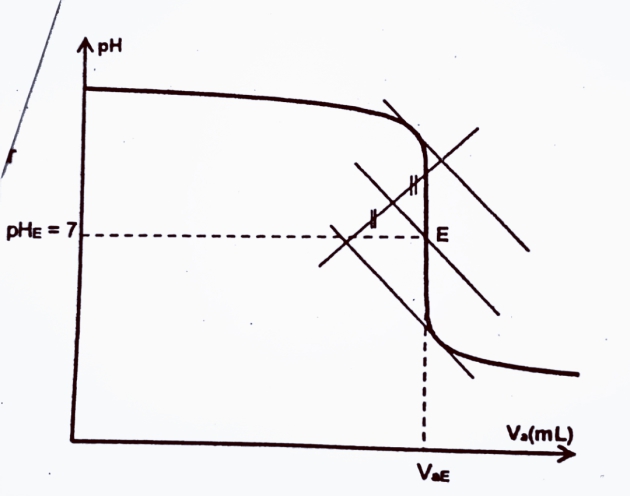
Si c'est le dosage d'une base forte par un acide fort, la courbe obtenue est décroissante et présente également trois parties différentes.Cette courbe de dosage a la forme suivante :