Equivalence acido-basique
Définition
A l'équivalence acido-basique, la quantité de matière d'ions hydronium ( H3O+) de la solution d'acide fort est égale à la quantité de matière d'ions hydroxyde (OH-) de la solution de base forte ajoutée (ou inversement).
Ainsi on aura n(H3O+) = n( OH-) c'est-à-dire CAVA = CBVBE où VBE est le volume de la solution de base forte versée.
A l'équivalence acido-basique, la valeur du pH est 7 et la solution obtenue est le chlorure de sodium ( Na+ + Cl- ) qui est une solution neutre.
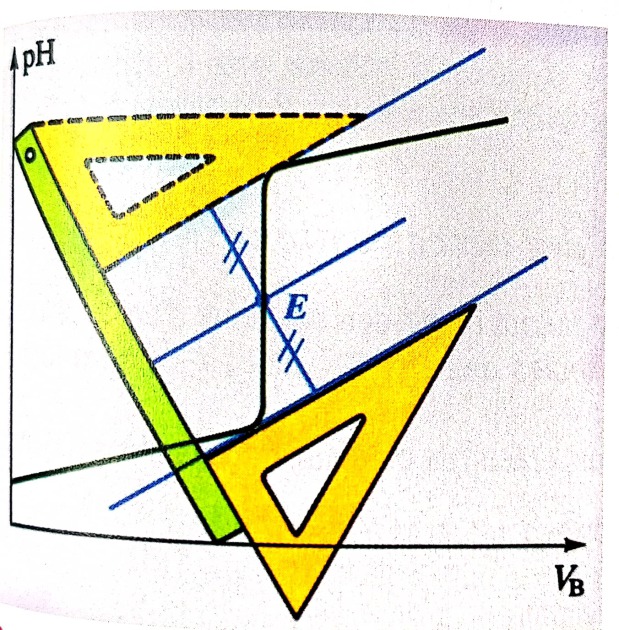
Comment déterminer les coordonnées du point d'équivalence (E)
A partir de la courbe de dosage, les coordonnées du point d'équivalence E sont déterminées à l'aide de la méthode des tangentes parallèles.
Méthode des tangentes parallèles : On trace une première tangente avant le saut du pH et juste après le saut du pH une deuxième tangente parallèle à la première, ensuite on trace la médiatrice de la distance séparant ces deux tangentes. Le point d'intersection de cette médiatrice avec la courbe est appelé point d'équivalence E.
Remarque :
Dans l'expérience réalisée ci-dessus :
le point équivalent E a pour coordonnées : E ( VBE = 20 cm3 ; pHE = 7 )
la solution obtenue à équivalence est une solution aqueuse de chlorure de sodium de concentration molaire C tels que :