Electrolyse de l'eau
1) Expérience
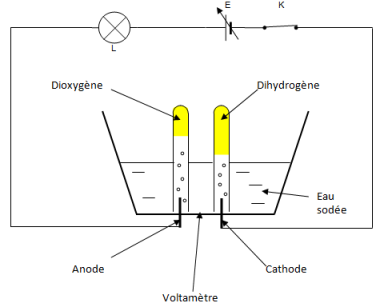
Une électrode est un conducteur plongé dans une solution conductrice.
L'anode est l'électrode reliée à la borne positive du générateur.
La cathode est l'électrode reliée à la borne négative du générateur.
L'eau pure ne conduit pas le courant électrique. Pour la rendre conductrice, on verse dans l'électrolyseur une solution de soude.
2) Observations
Des bulles de gaz se dégagent au niveau des électrodes.
Le volume de gaz recueilli à la cathode est le double du volume de gaz recueilli à l'anode.
3) Identification des produits formés
a) A l'anode
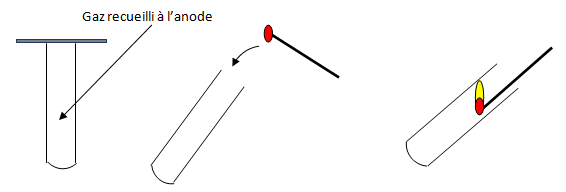
Le gaz recueilli à l'anode rallume une bûchette incandescente : c'est le dioxygène.
b) A la cathode
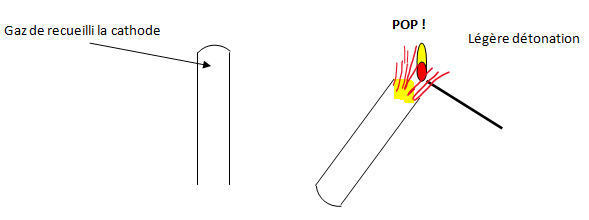
Le gaz recueilli à la cathode produit une petite détonation à l'approche d'une flamme (on dit que le gaz "aboie") : c'est le dihydrogène.
4) Conclusion
L'électrolyse de l'eau est la décomposition de l'eau par le courant électrique en dioxygène et en dihydrogène.
Le volume du dihydrogène est le double du volume du dioxygène.
V(H2) = 2 x V(O2)
Le rôle de la soude est d'apporter les ions nécessaires pour rendre l'eau pure conductrice.
5) Equation-bilan
2 H2O → 2 H2 + O2





