II) Réduction de l'oxyde cuivrique
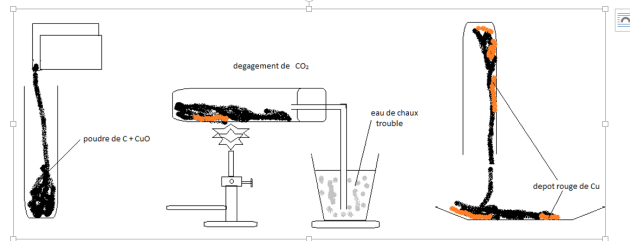
1) Description de l'expérience
2) Interprétation
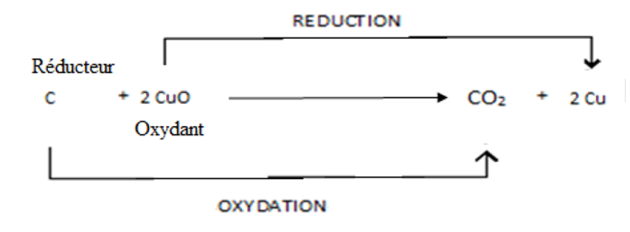
L'oxyde cuivrique, encore appelé oxyde de cuivre CuO et le carbone C disparaissent pour donner du cuivre Cu et du dioxyde de carbone CO2.
L'équation-bilan de cette réaction chimique s'écrit : 2 CuO + C → 2 Cu + CO2
Au cours de cette réaction, le carbone prend à l'oxyde cuivrique ses atomes d'oxygène et se combine avec ces derniers. On dit que l'oxyde cuivrique s'est réduit et que le carbone s'est oxydé.
Le passage de l'oxyde cuivrique au cuivre est appelé réduction : le carbone est le réducteur ou le corps oxydé.
Le passage du carbone au dioxyde de carbone est une oxydation : l'oxyde cuivrique est l'oxydant ou le corps réduit.
3) Conclusion
La réduction de l'oxyde cuivrique s'accompagne de l'oxydation du carbone.