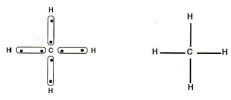
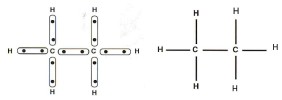
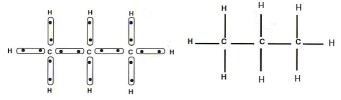
Représentation des plus simples alcanes
La formule brute ne renseigne pas sur la géométrie de la molécule. Pour avoir une vision plus étendue d'une molécule, nous pouvons utiliser :
Les modèles moléculaires ;
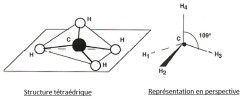
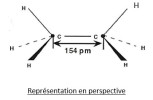
La représentation en perspective dite de CRAM
Fondamental :
Par Convention :
-Un trait plein (![]() ) représente une liaison dans le plan de la feuille ;
) représente une liaison dans le plan de la feuille ;
-Un pointillé (- - - - -) représente une liaison pointant en arrière du plan ;
-Un triangle plein (![]() ) représente une liaison pointant en avant du plan de la feuille.
) représente une liaison pointant en avant du plan de la feuille.
Remarque :
Chaque singulet d'un atome d'hydrogène H forme avec un singulet de l'atome de carbone C une liaison de covalence.
Le carbone possède quatre singulets ; il est dit tétravalent
L'hydrogène possède un singulet ; il est dit monovalent.
Géométrie de la molécule
Exemple :
L'éthane
Formule brute : C2H6
Le propane
Formule brute :C3H8
Formule semi-développée : CH3-CH2-CH3
Le butane
Formule brute : C4H10
Le butane possède deux isomères : le butane normal encore appelé n-butane et le butane à chaîne ramifiée.
Formule semi-développée : le butane a deux formules semi-développées :
CH3-CH2-CH2-CH3 : butane normal
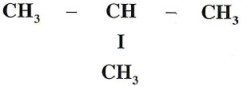 : butane à chaîne ramifiée
: butane à chaîne ramifiée