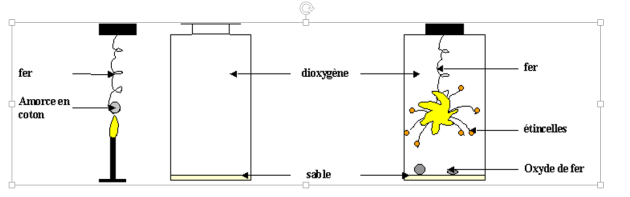
III) La combustion du fer
1) Description de l'expérience
2) Interprétation
Au cours de cette combustion, du fer et du dioxygène disparaissent. Il se forme de petits morceaux d'un oxyde de fer appelé oxyde magnétique de fer. La combustion du fer est donc une réaction chimique.
3) Equation-bilan
Les réactifs sont le fer (Fe) et le dioxygène (O2). Le corps formé est l'oxyde magnétique de fer (Fe3O4).
L'équation-bilan de la combustion du fer s'écrit : 3 Fe + 2 O2 → Fe3O4.
Cette réaction chimique est exothermique.
NB : L'oxyde magnétique de fer est un solide gris et aimanté.
IV) La formation de la rouille
Au contact de l'air humide, le fer se recouvre lentement d'une couche de rouille de couleur rouge brun. La rouille est essentiellement constituée d'un autre oxyde de fer appelé oxyde ferrique dont la formule chimique est Fe2O3.
L'oxyde ferrique est un produit de la réaction chimique entre le fer et le dioxygène.
L'équation-bilan de la réaction s'écrit : 4 Fe + 3 O2 → 2 Fe2O3.
La formation de la rouille dégage de la chaleur, mais la lenteur de la réaction ne permet pas de la détecter : la chaleur disparaît peu à peu dans l'air.
V) Oxydation lente et combustion
Au cours des réactions chimiques étudiées dans ce chapitre, le dioxygène réagit avec le carbone, le soufre et le fer pour donner des oxydes : dioxyde de carbone, dioxyde de soufre, oxyde magnétique de fer et oxyde ferrique. De telles réactions chimiques sont appelées oxydations.
Une combustion est une oxydation qui dégage rapidement beaucoup de chaleur avec apparition d'une flamme ou d'une incandescence. Quand l'oxydation est trop lente pour que la chaleur dégagée puisse être détectée, on l'appelle oxydation lente (c'est le cas de la formation de la rouille).